Présentation
Les hydrocarbures aromatiques polycycliques (HAP) sont un groupe de plus de 100 composés organiques constitués de plusieurs cycles aromatiques liés entre eux. Les HAP sont produits lors de la combustion incomplète ou de la pyrolyse de matières organiques. Les principales sources anthropiques d’émissions sont la combustion incomplète ou la pyrolyse de matières organiques (émissions provenant des gaz d’échappement des véhicules à moteur en particulier les moteurs diesel, du chauffage domestique, de la cuisine, et la fumée de tabac) et l’incinération de déchets agricoles (Patel, 2020). Les HAP peuvent également être produits par des processus naturels, tels que les éruptions volcaniques et les incendies de forêt.
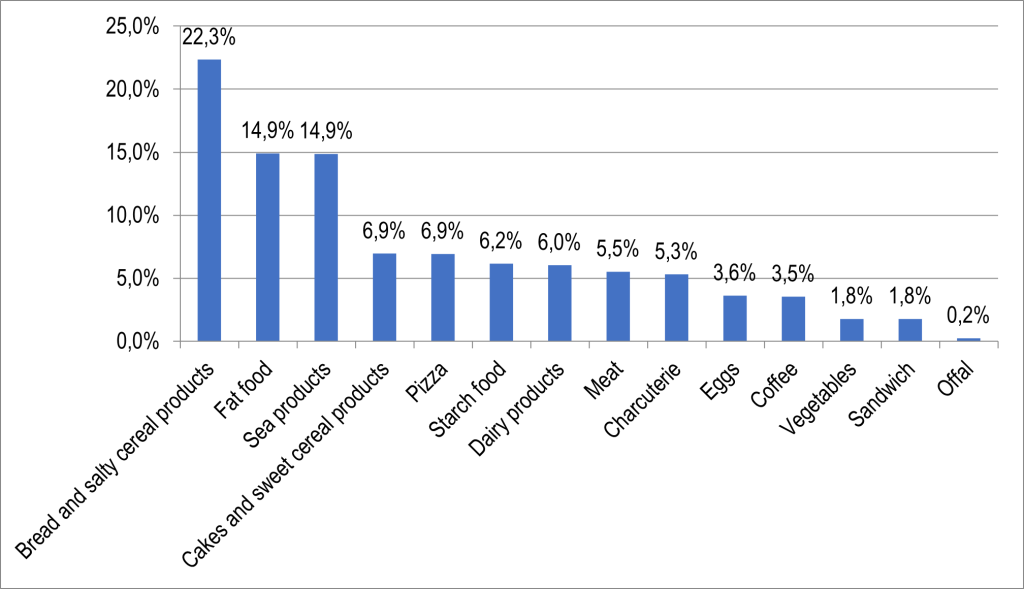
La population générale peut être exposée aux HAP par l’inhalation (pollution de l’air intérieur et extérieur), par ingestion (l’eau et des aliments contaminés), ainsi que par le contact avec la peau.
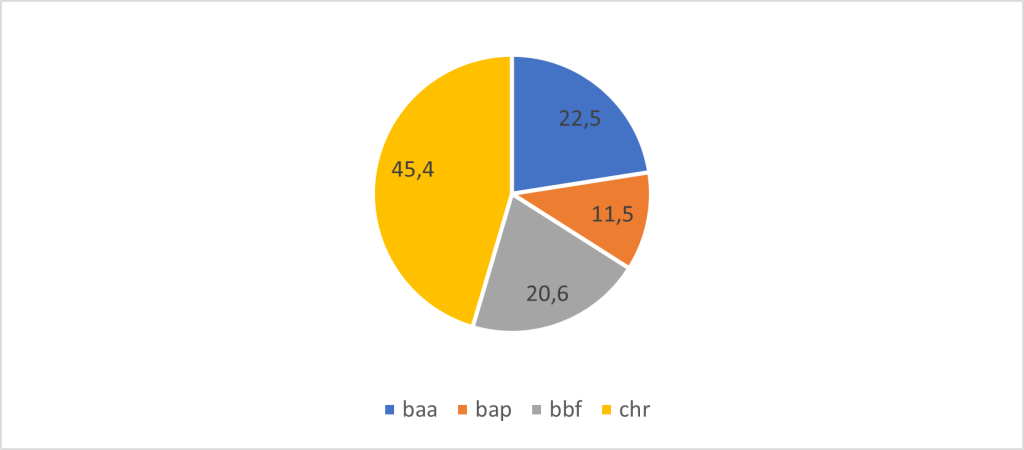
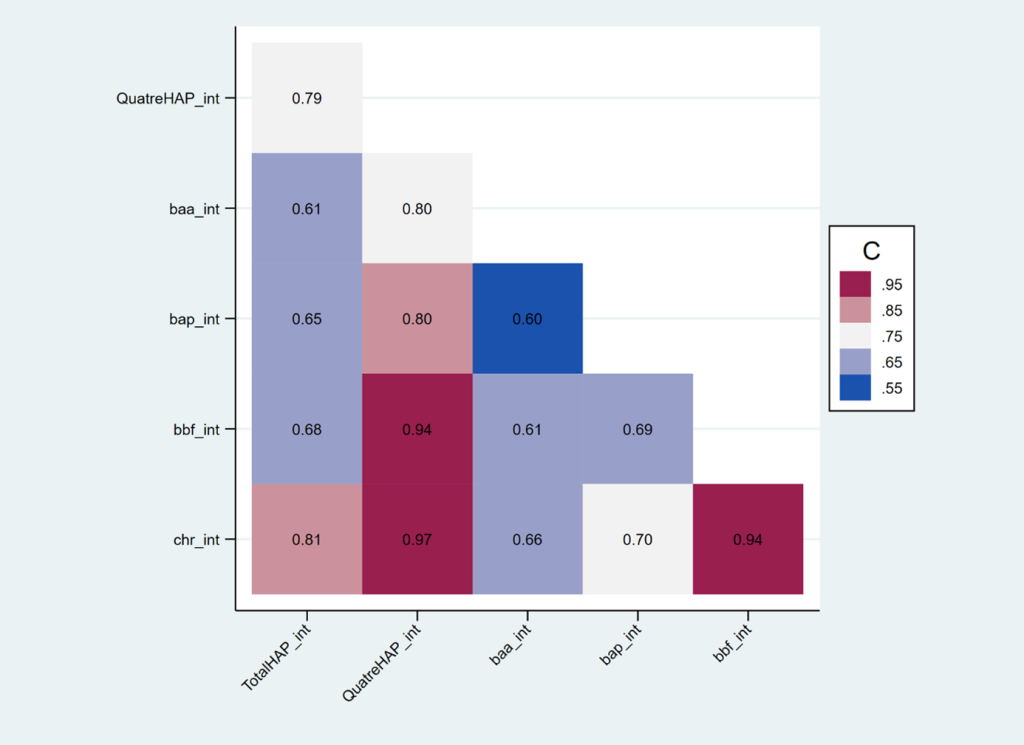
Parmi les centaines de HAP connus, 16 ont été désignés comme polluants hautement prioritaires par l’agence de protection de l’environnement des États-Unis (US EPA – U.S. Environmental Protection Agency), en raison de leur toxicité potentielle, ainsi que de leur prévalence et de leur persistance dans l’environnement. Le benzo[a]pyrène (BaP) est l’un des 16 HAP le plus connu et le mieux caractérisé de la famille des HAP. Le BaP est utilisé comme substitut pour l’estimation de l’exposition totale aux HAP dans les études épidémiologiques, car sa fraction est relativement stable dans le complexe des HAP (Beyea, 2006).
L’exposition aux hydrocarbures aromatiques polycycliques est une préoccupation majeure pour la santé humaine et un problème de santé publique, à cause de ses effets néfastes sur la santé humaine. Les HAP sont classés comme polluants organiques persistants (POP) qui sont des composés persistants, toxiques et omniprésents. Les HAP sont également considérés comme des perturbateurs endocriniens qui sont associés à l’augmentation de risque de plusieurs maladies telles que respiratoires et certains cancers (Archibong, 2012 ; Rocha, 2021). Certains HAP ont des propriétés cancérogènes, parmi les 16 HAP considérés comme toxiques par l’US EPA, le Centre international de Recherche sur le Cancer (CIRC) a classé le benzo[a]pyrène (BaP) comme cancérogène pour l’humain (Groupe 1), et le chrysène (CHR), le benzo[a]anthracène (BaA) ou le benzo[b]fluoranthène (BbF) comme possiblement cancérogènes pour l’humain (Groupe 2B) (CIRC, 2010). En effet, l’exposition chronique aux HAP peut augmenter le risque de développer différents types de cancer, notamment le cancer du poumon, le cancer de la peau, le cancer de la vessie, le cancer du foie et d’autres cancers (Gamboa-Loira, 2022 ; Mallah, 2022). Des études épidémiologiques ont également montré que les HAP sont associés à une réduction de la fonction pulmonaire, à une exacerbation de l’asthme ; à une augmentation de risque de maladies pulmonaires obstructives et cardiovasculaires.
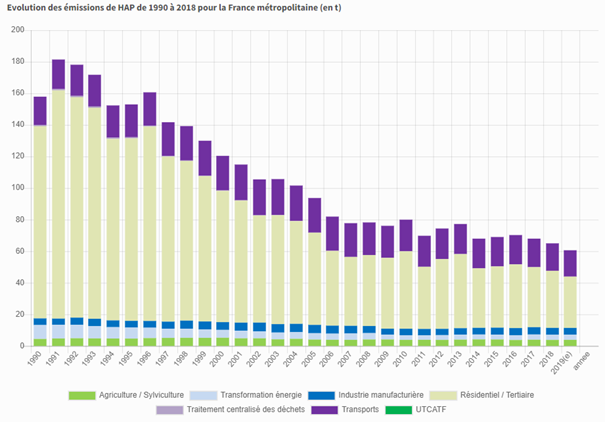
Du fait de leur large présence dans l’environnement et de ses effets nocifs sur la santé, les HAP sont réglementés dans le monde et dans plusieurs pays, afin de limiter et de réduire leurs émissions dans l’atmosphère, ainsi que leur présence dans les produits alimentaires.